利用流式細胞術(intracellular cytometry)對細胞內靶點進行分析提出了許多技術挑戰,這些挑戰在測量細胞表面表位或測量活細胞中染料攝取/處理(例如鈣黃綠素AM)時通常不會遇到。一般來說,細胞(懸浮液)必須首先“固定”以保存和維持目標表位的結構和位置,然后“通透”以允許探針(例如抗體)理想地進入所有細胞室(細胞質、線粒體、核糖體、細胞核等)。
一般來說,細胞固定是通過使用交聯固定劑(如甲醛、戊二醛)或低分子量醇(甲醇、乙醇)來完成的,它們通常起到“凝固”蛋白質的作用。甲醛的優點是一般保持天然蛋白質的整體構象。然而,由于甲醛在肽、多糖和脂類上產生多個反應位點,因此交聯可以隱藏或隔離表位,使得它們在固定后不能自由地被抗體探針獲得。在翻譯后蛋白質修飾(如磷酸化、甲基化、乙酰化、泛素化等)的研究中,甲醛固定的另一個好處是,甲醛似乎既能“固定”目標氨基酸(絲氨酸、蘇氨酸、酪氨酸)的修飾,并且還抑制活細胞中這些靶點的降解(例如,磷酸化的磷酸酶去除,甲基化的去甲基化酶去除,等等)。相比之下,酒精固定通常會導致一些(磷酸化和潛在的其他蛋白質)修飾的檢測較差。
全血樣本的固定
免疫學領域的研究經常利用外周血、淋巴結或骨髓細胞,通常通過初步純化步驟(Ficoll–Hypaque、低滲溶解、氯化銨)去除紅細胞。此外,初步純化技術可以去除潛在的靶細胞群(例如,使用Ficoll–Hypaque的細胞損失)。本節首先介紹含紅細胞樣本的固定和滲透技術,然后介紹分離細胞群(組織培養細胞、分離淋巴細胞、單核細胞等)的固定和滲透技術。
固定后,進行細胞通透,以獲得進入細胞內部。滲透用試劑包括有洗滌劑(例如Triton X-100,NP-40)或皂化劑(例如皂甙)或低分子量醇(甲醇或乙醇)。本文介紹一種用于臨床樣本(全血、骨髓)的固定和滲透技術。將固定劑甲醛直接添加到臨床樣本中(立即“固定”磷酸化表位,并防止信號抑制劑從細胞中分離出來,從而導致其抑制作用的快速逆轉)。再以適當的濃度和時間將Triton X-100直接添加到樣品(仍含有甲醛)中,可實現紅細胞溶解和白細胞固定,而不會造成白細胞數量的顯著損失。注,嚴格遵守孵育時間是很重要的。
如圖14所示,使用甲醛/Triton X-100技術固定滲透的健康人全血各群分布。單核細胞群(藍色)的位置是用CD14確定的。然而,單用散射光信號從細胞碎片中分離淋巴細胞是有問題的,紅細胞裂解產生大量碎片與淋巴細胞重疊。結合CD45/CD14可將淋巴、單核、粒細胞清晰區分。顯示的數據是在紅細胞裂解步驟后的一次洗滌結果,增加額外的洗滌步驟可顯著減少碎片數量。
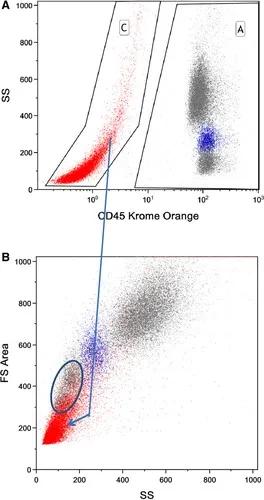
圖14. 甲醛固定人全血,TX-100通透。用CD14-PE-Cy7和CD45-KromeOrange鑒定白細胞群。碎片(紅色)通過CD45與SS(上圖C)進行識別。使用CD14 PE-Cy7(未顯示)完成外周血單核細胞的鑒定(圖中藍色)。
全血染色材料
全血固定通透過程
甲醇對表位染色的影響
一些細胞內或核內的表位在使用上述甲醛-Triton固定、通透后仍然很難被抗體探針獲得。這可能是所有類似的醛-洗滌劑(僅)固定和滲透技術的局限性,如磷酸化STAT蛋白就不能被檢測到。用冷(4°C)甲醇處理固定和滲透細胞5-10min后即可檢測到這些表位,但須小心驗證甲醇處理的效果,特別是熒光抗體染色后處理和使用下文所述的串聯染料時。如圖15所示,用高達50%的冷甲醇處理固定和滲透的全血(使用GM-CSF激活)后,P-STAT5染色結果和未處理樣品信號強度相似。而,用80%冷甲醇處理會產生明顯更強的P-STAT5信號。圖15還顯示了50%(上)和80%(下)濃度的甲醇處理對P-ERK和P-S6染色(核糖體S6蛋白)的影響:P-ERK信號強度的變化最小,P-S6信號降低約20%。因此,需測試確定不同濃度甲醇處理對不同靶表位的影響。
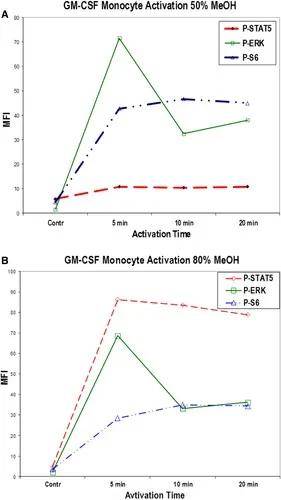
圖15. 不同濃度甲醇處理,對GM-CSF體外激活不同時長的外周血單個核細胞上磷酸化分子檢測的影響。正常供體的全血在37°C下用GM-CSF在體外處理20min。一部分固定和通透樣品在4°C下用50%甲醇處理(A),另一部分用80%甲醇處理(B)。洗滌后,所有樣品用(_?_)P-STAT5、(_□_)P-ERK和(_Δ_)P-S6染色。
雖然甲醇進一步處理對某些磷酸化表位的評估很重要,但它也具有降低(或消除)用于檢測特定細胞群的其他重要表位的信號。根據作者經驗,對人血液或骨髓中的某些髓系-單核細胞標記物(CD14、CD33、CD64)影響較大,而對干細胞或祖細胞標記物(CD34、CD117)影響較小。
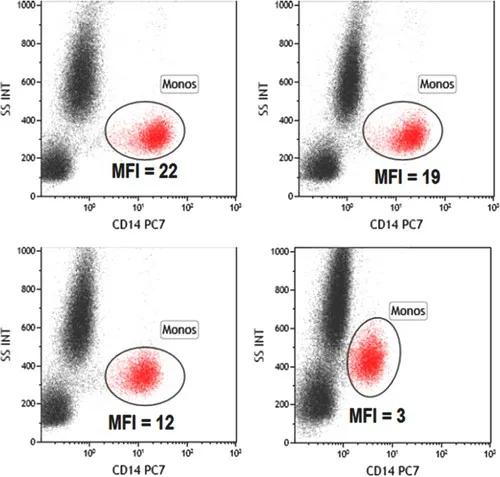
圖16. 甲醇處理對人外周血單核細胞CD14染色的影響。在固定和滲透之前(左)或之后(右)染色CD14 PE-Cy7。樣品用50%(上)或80%(下)甲醇處理。左上-左下比較顯示了不同濃度甲醇處理對染料的影響,左右比較顯示了甲醇處理對抗原表位的影響。
非貼壁組織培養細胞的固定和通透
組織培養細胞(錨定非依賴性細胞系)的常規固定和通透是通過甲醛固定,無水甲醇對細胞質和核膜進行通透。通常需同時對細胞表面和細胞質或核內表位進行染色,一般會先染表面再固定通透染胞內,尤其是單獨使用酒精固定處理而改變(如CD19)或破壞(如CD14、CD15、CD64)的細胞表面標記。
甲醛固定劑最佳濃度的測定
磷酸化表位的最佳檢測似乎受到用于固定不同類型細胞的甲醛濃度的影響。如圖17所示,在用0.05到0.4%的甲醛(37°C,10min)處理后,K562細胞中的P-STAT5最佳檢測。由于潛在表位交聯/固定的程度與甲醛濃度、孵育時間和溫度成正比,所有這三個變量每次都應進行相同的控制和執行。如圖17所示,在較高的最終甲醛濃度下,P‐STAT5信號降低,可能是由于過度固定和抗體結合物限制了磷酸表位的可及性。如圖17所示,單獨用無水甲醇處理(無甲醛:第一數據點)產生背景水平的信號。
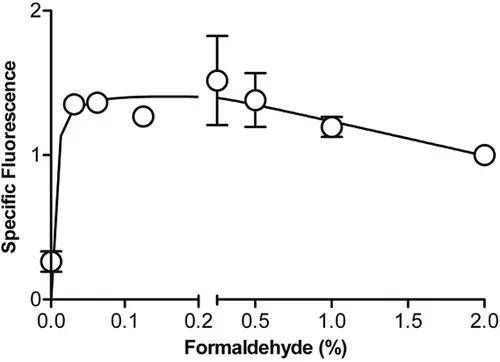
圖17. 甲醛濃度對K562細胞中P-STAT5染色結果的影響。不同濃度甲醛固定細胞,37°C,10min,滲透并用抗P-STAT5PE染色。
非貼壁培養細胞的常規固定、通透和抗體染色
對于非貼壁組織培養細胞的固定和通透,我們在組織培養基(通常含有15-20%的FBS)中直接向亞融合細胞(理想情況下在收獲前12-24小時重新喂食)中添加最佳濃度的甲醛,將細胞放回37°C的組織培養箱中培養10分鐘,然后離心(400×g,10分鐘),并使用渦流混合器進行再懸浮(注:此時細胞聚集,需要用渦流進行劇烈處理,以實現所有細胞的再懸浮)。渦流時,添加無水甲醇(儲存在-20°C下),添加~1 mL無水甲醇每107個細胞。在這一點上,細胞可以在-20°C的密封容器中儲存數周,而磷酸化表位(目前測試的表位)的檢測沒有明顯減少。
對于細胞內表位的染色,將3–5×106個細胞放入每根試管(我們常規在1.2 mL微管中對組織培養細胞進行染色)。離心管(對于冷凍微量離心機,使用10 000rpm持續12 s),小心地吸取上清液,并將細胞團重新懸浮在1mL冷(4°C)洗滌液(Dulbecco的PBS/5%FCS或Dulbecco的PBS/5%無蛋白酶BSA)中,同時渦旋。將試管放在冰上5分鐘,以使緩沖液平衡并除去殘余酒精。如上所述離心。重復上述步驟,用冷洗滌液清洗兩次。
在最后一個離心步驟后小心地去除上清液,并將細胞重懸在100μL抗體預混物中。重要的是,每種抗體都要滴定,以確保最佳的信噪比。冰(4°C)上避光孵育30分鐘。
將細胞重新懸浮在0.5 mL冷洗滌液中進行流式細胞術分析(如果細胞要在1-2hr內進行分析)。更長時間后再進行分析,則將洗滌后的細胞離心,并將細胞團重懸在冷PBS/0.1%多聚甲醛中。在0.1%多聚甲醛中固定并在4°C避光下儲存的細胞至少穩定24hr(光散射和磷酸表位檢測)。應注意的是,一些磷酸表位的信號強度在冷洗滌液(如P-S6)中最終再懸浮的幾分鐘內開始顯著降低。對于這些表位,強烈建議立即將細胞置于PBS/0.1%甲醛中,這可顯著降低信號丟失率。